- 内視鏡専門医・指導医による、切除前の丁寧な病変観察と適切な適応診断
- 安全で有効性の高い、コールドスネアポリペクトミーを主体とした治療
- 大腸内視鏡検査(大腸カメラ)で対象のポリープが見つかったら、そのまま日帰りでの切除が可能
当クリニックでは、大腸内視鏡検査(大腸カメラ)で切除対象のポリープが見つかった際に、そのまま大腸ポリープ切除に切り替えて日帰りでの切除を行うことが可能となっております。
そのため大腸カメラ予約のための事前診察での説明時に、すべての患者さまに大腸ポリープ切除の説明も前もって行わせて頂いております。
以前は本邦におきましては多くが入院加療を要してきた大腸ポリープの治療ですが、近年はコールドスネアポリペクトミーなどの治療法の進歩によって、ほとんどが日帰りで治療することが可能となってきました。また当クリニックでは、同時に複数の病変の切除を行うことも可能となっています。
これまで忙しくて治療せずに放置してきた大腸ポリープなどをお持ちの方も、ぜひ一度当クリニックへご相談ください。
大腸内視鏡検査(大腸カメラ)でポリープを見つけた際には、病変の大きさだけでなくその形態、色調、表面構造などから病変の組織型の診断を行います(良性なのかがんなどの悪性なのかなど)。その上で内視鏡的に切除する対象となる病変なのか、それとも手術で切除する必要があるのかなどを鑑別し、さらに内視鏡的な切除対象となるのであれば、どのような方法が適しているのかを判断致します。
当クリニックでは経験豊富な内視鏡専門医・指導医が全例で画像強調機能を用い、原則として拡大内視鏡での検査を行っているため、正確な内視鏡診断および適切な治療適応の判断を行うことが可能です。
また千葉大学病院へも非常勤講師として勤務しているため、最新の診断法・治療法をアップデートすることで、常に皆さまに質の高い治療を提供させて頂くことが可能となっております。
当院の院長もその発展と普及に尽力してきた、高い安全性と有効性を両立した治療法です。
合併症の非常に少ない優れた治療法であることから、近年大腸ポリープの外来切除法として急速に施行件数が増えてきています。当クリニックではこのコールドスネアポリペクトミーを主体としたポリープ切除を行っています。
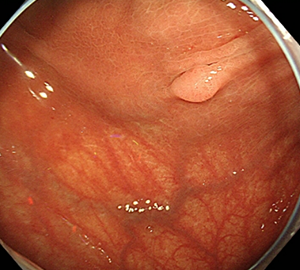
1:ポリープを見つけます。
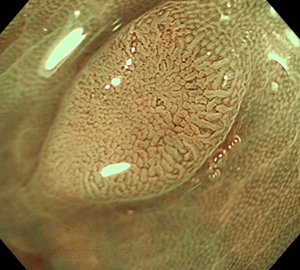
2:NBI併用拡大観察で詳細に観察します。
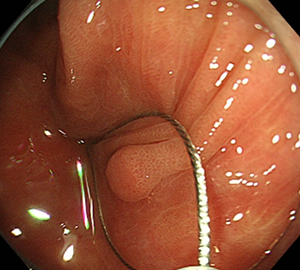
3:病変をスネアに通します。
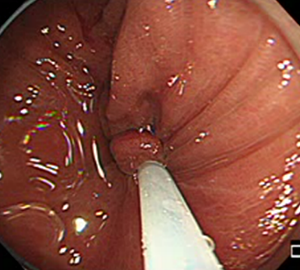
4:周囲の正常粘膜をしっかり入れながら、病変を絞扼していき…
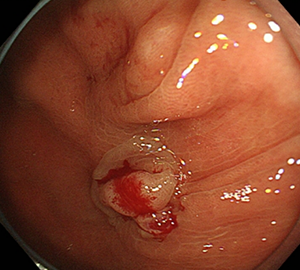
5:切除します。切除検体は吸引回収し、病理検査を行います。
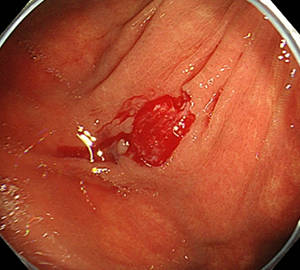
6:切除後に洗浄・観察して、病変の遺残がないことを確認します。
必要に応じて、通電を併用するホットスネアポリペクトミー(HSP)を行うこともあります。
比較的大きめの大腸ポリープや平坦な病変などの切除の際に行います。
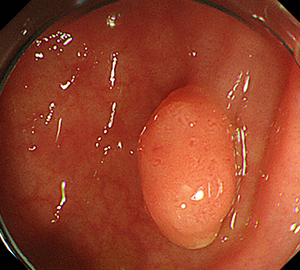
1:ポリープを見つけ、NBI併用拡大観察をした後…
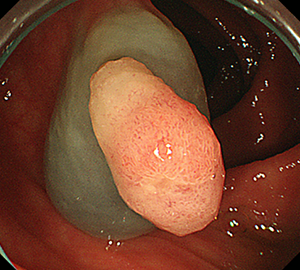
2:ポリープ直下の粘膜下層に局注液を注入します。
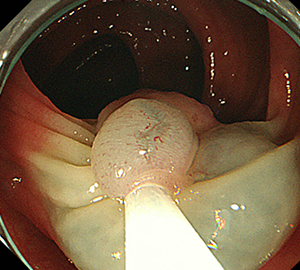
3:ポリープをスネアに通し、周囲の正常粘膜を入れて病変を絞扼し…
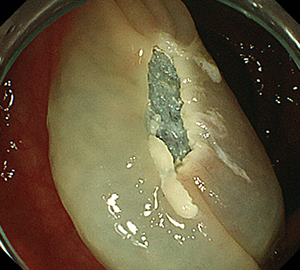
4:通電して切除し、周囲を観察して病変の遺残がないことを確認します。
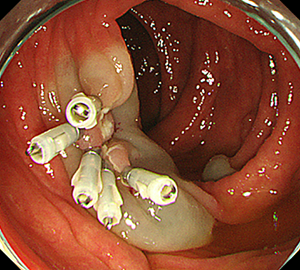
5:切除面をクリップで縫合閉鎖し、回収した検体の病理検査を行います。
ポリープの切除後には、まれですが数日間は出血などの合併症を生じる可能性があります。これを抑えるため当日のご帰宅後は安静に過ごして頂き、約3日間のお食事の制限、および飲酒・喫煙の制限が必要となります。具体的には、食べて良いもの(○)、控えた方が良いもの(×)は下記の通りです。
○:炭水化物(ご飯・麺類・パン)・肉・魚・豆腐・水分(野菜/果物ジュース・酒類以外)
×:豆類(小豆・ごま・納豆など)・野菜・果物・海藻・こんにゃく・乳製品・野菜/果物ジュース・酒類
当クリニックにおきましては、胃・大腸内視鏡検査(胃カメラ・大腸カメラ)を同日にお受け頂くことが可能となっております。
ご自宅もしくは当クリニックで腸管洗浄液を服用して頂き、胃カメラをお受け頂いた後、大腸カメラをお受け頂く形になります。
胃カメラ・大腸カメラを同日施行希望の方は、ご遠慮なくお申し出ください。
| 事前診察(感染症採血を含む) | 約1,500円(1割負担)、約4,000円(3割負担) |
|---|---|
| 大腸カメラと日帰りポリープ切除 | 約7,000~10,000円(1割負担)、約20,000~30,000円(3割負担) |
※ 上記は短期滞在手術等基本料1を含みます。これは厚生局によって、内視鏡治療施設としての医療設備・看護師配置・診療体制などが高い水準にあると認定された医療機関において、その算定を行うとされているものです。当院はこの施設基準を正式に認定されています。
以下は、当院の院長が著書にまとめたり講演でお話しさせて頂いていたりする、実際に内視鏡的治療を施行されている医師の先生方へ向けた治療戦略の説明の抜粋です。
医師向けとなっておりますので、専門用語が多くやや難しい内容となっております。
治療を行う前に内視鏡診断を適切に行い、内視鏡的治療適応外となる粘膜下層(SM)深部浸潤がんを鑑別して除外します。
径10mm未満の腺腫はコールドポリペクトミー(CP)の対象となりますが、以下の病変は内視鏡的粘膜切除術(EMR)などの通電を用いた処置で確実に切除します。
①陥凹型病変を含むnon-polypoid病変
②がんを含む可能性のある病変
CPの方法としては、摘除を行う病変がすべて径3mm以下ならばCold forceps polypectomy (CFP)も適応となりますがその頻度は低く、一般にはCold snare polypectomy (CSP)が適応となることがほとんどです。
ただし有茎性病変では、CSPは径5mm以下の微小病変にとどめ、径6mm以上の病変にはhot snare polypectomy(HSP)を施行した方が良いでしょう(時に留置スネアも併用)。
径10mm以上やnon-polypoid、担がん病変ではEMRの対象となりますが、一括切除が難しいと思われる場合には、内視鏡的粘膜下層剥離術(ESD)での確実な切除を行います。
以下では本治療戦略について、根拠となる文献などにも言及しながら詳述していきます。
径5mm以下の腺腫であってもがん化リスクがあり、微小病変も含めて内視鏡的に発見した腺腫性病変の全摘除(クリーンコロン化)を行うことによって、大腸がんの発生の抑制と死亡率の低下がもたらされることが明らかとなっていることからも1)、世界的にクリーンコロンの達成が治療のスタンダードとされています。
CFPは生検と同様に鉗子で把持してポリープを摘除するという非常に安全性が高い手技で、後出血や穿孔などの合併症はほとんどありません。
しかしながらこれまでの研究から、一噛での内視鏡的完全摘除率は径4mm以上の病変では9割を切ること、径4mm以上の病変においては組織学的完全切除率が径3mm以下の病変に対してよりも有意に低いことなどが分かっているため、径4mm以上の病変に対しての施行は基本的には避けるべきでしょう。
CSPもこれまでの多くの報告から、後出血や穿孔などの合併症の発生率はきわめて低く、安全性に大変優れた手技といえます。
本邦で施行された4~9mmの無茎性病変に対してのCSPとHSP(EMRも含む)のRCTにおいては、切除直後に潰瘍辺縁2ヵ所から生検を施行し腺腫がなければ完全切除と定義した際の完全切除率は、CSPで98.2%でありHSPの97.4%に対して非劣性が示されており、径9mm以下の病変に対してはCSPはHSPと同等の有効性を有しているといえます2)。
また千葉大学病院におけるわたしのまとめでも、径9mm未満の腺腫に対してのCSP後のフォローアップ内視鏡および生検での遺残再発率も、0.98%という低頻度にとどまっています3)。
ただし大き目の有茎性病変では茎部の動脈が太いため径5mm以下の微小病変にとどめておくべきで、切除後は茎部を横断する形でクリッピングを施行して後出血の予防を行う必要があります。しかしながら径6mm以上の病変であっても、茎部に一定の長さがあり根部にクリッピングを先行して病変のうっ血が確認できれば(病変部の暗赤色化)、切除後の動脈性出血の可能性は極めて低く、CSPの対象として問題はないと思われます。
径10mm以上の病変に対してのCSPではいくつかの報告からは、径10mm未満の病変の際と比してR0切除(検体の病理診断における病理学的完全切除)率が低く、また径10mm以上の病変においては分割切除率や担がん率も高いことが分かっています4)。
逆にCFPの対象とも成り得る径3mm以下の病変においては、千葉大学病院のデータ上は径4mm以上の病変と比して一括切除率、R0切除率とも差はなく、径3mm以下の病変に対してもCSPを行うことは理にかなっています。
以上からCSPは径9mm以下の病変にとどめ、径10mm以上の病変に対してはEMRを含めたHSPが望ましいといえますが、径9mm以下の無茎性病変すべてに対してCSPが適応となるかというとそうではありません。
CSPにおいては以下の理由から腫瘍遺残の懸念があるとされています。
①側方断端の焼灼効果がない
②切除深度が通常粘膜筋板直下~粘膜下層浅層部(粘膜筋板の切り残しも)
さらにCSPにおいては不完全切除の独立した因子としてnon-polypoid病変のほか担がんが挙げられており、担がん病変は取り残してはならないにもかかわらず、CSPで取り残しやすいものとなっており、このような病変においては径9mm以下であってもEMRなどで適切に切除する必要があります。
安全性と有効性から総合して考えると、径9mm以下の病変のほとんどはCSPの適応ということになりますが、一部の病変はEMRで切除した方が良いため、これをしっかりと内視鏡的に診断することが肝要です。またEMRにおいてはCSPと比較すると後出血などの合併症の頻度も高いため、この点への留意も必要です。
大腸がん研究会による多施設前向き検討による、径5mm以下の大腸微小病変における担がん病変の特徴としては、以下の5つが挙げられています5)。とくに②はnon-polypoid growth(NPG、腫瘍粘膜部が辺縁粘膜と同等かそれよりも菲薄化している病変)にも通じ、小病変でもSMがんである頻度が他の病変よりも高く要注意です。ほか不均一な粘膜構造、強い発赤や周囲の白斑もがんで多い特徴といえます。
①緊満所見(粘膜下腫瘍のような張った所見)
②広基性病変で立ち上がり正常粘膜
③面状陥凹
④陥凹内凹凸
⑤粘膜粗造(光沢がなくザラザラした所見)
このような病変に対しては、Narrow Band Imaging(NBI)(もしくはBlue Laser Imaging [BLI])併用拡大内視鏡観察を行い、Japan NBI Expert Team(JNET)分類に沿った診断を行っていきます6)。これらの所見を有さない病変に対しても、環境があれば是非施行すべきです。Type 2B病変ではSM深部浸潤がんを含むことがあるため、クリスタルバイオレット染色併用拡大内視鏡検査を行い、内視鏡的切除適応外のSM深部浸潤がんを鑑別することが肝要です。
一般的な内視鏡的摘除のコツとしては以下が挙げられるかと思います。
①先端フードの活用
②スコープ直線化
③腸液吸引
④体位変換活用
⑤送気量調整
⑥病変の画面下側ポジショニング
⑦必要に応じたスコープの反転
CSP施行時には、これに加えて以下の点を注意すると良いでしょう。
①可及的に病変周囲正常粘膜を含めたスネアリング(burning effectがないため)。
②検体回収時は吸引ボタンをフルに押し込むか、吸引ボタンを外して指で抑える。
CSPで切除しきれなかった場合のほとんどは、粘膜筋板を切除しきれていないことが原因であり、軽くスネアを緩めて心持ちスネアを持ち上げて絞扼し直し、それでも切れない場合はHSPに切り替えます。しかし個人的にはHSPへの変更の前に、鉗子口に引き込んでの切除を試みても問題はないかと思います。実際この方法で穿孔などの経験はなく、病理診断上も問題はありません。ただし引き込んで一定の抵抗を感じる際は、切除方法を変更する必要があります。
内視鏡的切除適応となる病変に関しては、がんが疑われる病変では一括切除が原則であり、とくにSM浸潤がんの場合は正確な深達度診断や脈管侵襲の診断がその後の追加治療の要否にあたり必須であるため、EMRでの一括切除が難しい場合にはESDを選択します。
ただしESDには手技難度や時間、合併症などの短所もあるため、EMRでの一括切除が不可能な病変であっても、場合によっては分割EMR(EPMR)も許容されます。とくに側方発育型腫瘍(LST)においては、非顆粒型(LST-NG)は多中心性のSM浸潤を認めることが多いため適応とはなりませんが、顆粒型(LST-G)においては拡大観察を併用することによって局所的ながん化の診断が可能であるためEPMRの適応と成り得ます。その際はがん部で検体が分断されないように、計画的なEPMRを行う必要があります。いずれにしても、できるだけ分割切除検体数を少なくして局所再発の頻度を下げることが肝要です。ただし個人的には、部分的にでもがんを含む病変に関してはEPMRよりもESDを行うことが望ましいと考えています。
文献
1)Zauber AG, et al. N Engl J Med. 2012; 366: 687-696
2)Kawamura T, et al. Gut. 2018; 67: 1950-1957
3)Maruoka D, et al. Endoscopy. 2018; 50: 693-700
4)Hirose R, et al. Dig Endosc. 2017; 29: 594-601
5)斉藤裕輔, ほか. 胃と腸. 2009; 44: 1047-1051
6)斉藤豊, ほか. Gastroenterol Endosc. 2016; 58: 2314-2322
※ 文献3は院長の大学病院常勤時代の仕事の一つ、CSP後にほとんど再発がないことを初めて実際に示した論文です。
※ 音声がありますので、再生の際はご注意ください。